Main EF
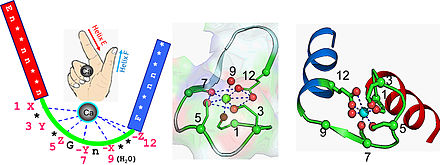
La main EF (EF Hand) est un motif structurel observé dans les protéines, il est constitué de l'association deux hélices α liées à une boucle formée d'une douzaine d'acides aminés. Cette structure enserre un ion Ca2+. Ce domaine protéique a la forme d'une main dans laquelle l'ion Ca2+ se situerait dans la paume et les deux hélices formeraient le pouce et l'index relevés. Ce motif structurel ou plusieurs de ces motifs peuvent être trouvés dans les protéines fixant le calcium ou dans les protéines impliquées dans la régulation du niveau de calcium intracellulaire comme la calmoduline.
Site de fixation de l'ion Calcium
[modifier | modifier le code]L'ion calcium est coordonné dans une configuration pentagonale bipyramidale. Six acides aminés impliqués dans la coordination avec l'ion calcium sont situés sur la boucle reliant les deux hélices α, leurs positions sur cette boucle sont 1, 3, 5, 7, 9 et 12 ; dans certains cas ces résidus sont désignés par les lettres X, Y, Z, -Y, -X et -Z. L'ion calcium est lié avec deux atomes du squelette de la chaine polypeptidique et par les chaines latérales des acides aminés souvent possédant des oxygènes, en particulier en position 12 où un acide aminé acide glutamique ou acide aspartique est toujours présent, ce ligand bidentate peut ainsi fournir deux oxygènes pour se lier à l'ion calcium. Le sixième résidu de la boucle est systématiquement une glycine qui permet de satisfaire aux contraintes géométriques de la chaine polypeptidique. Les acides aminés de la boucles, non impliqués dans la chélation de l'ion calcium sont généralement hydrophobes et vont stabiliser les deux hélices α.
Les changements conformationnels au niveau des mains EF lors de la chélation de l'ion calcium permettent la régulation de la concentration comme observée sur les protéines effectrices comme la calmoduline (CaM) et la troponine C (TnC) ou les protéines liées à l'homéostasie du calcium comme la calréticuline et la calbindine. Le motif main EF est majoritairement trouvé par paire dans les protéines chélatant le calcium même si un seul motif est parfois trouvé dans des protéines procaryotes ou eucaryotes. Plusieurs bactéries disposent d'un motif structurel proche de la main EF avec des propriétés de coordination similaires dont la différence la plus notable est la longueur de la boucle qui possède en moyenne 29 acides aminés.
Prédiction
[modifier | modifier le code]L'étude systématique de la structure primaire des protéines par recherche de signature de motif est un des moyens les plus simples pour identifier les motifs mains EF chélatant le Ca2+. En se basant sur les résultats de l'alignement de séquences de motifs main EF classiques, en particulier sur les chaines latérales impliquées dans la chélation du Ca2+, un programme de prédiction a été créé [1].
Classification
[modifier | modifier le code]Depuis la caractérisation du motif en main EF en 1973, la famille des protéines à motif structurel en main EF a été élargie pour inclure 66 sous-familles. Les motifs en main EF sont divisés en deux classes principales :

Les motifs mains EF canoniques comme dans la calmoduline (CaM) où la boucle de 12 acides aminés liant le Ca2+ par des groupes carboxylates de chaines latérales ou des groupes carbonyles d'acides aminés situés en position 1, 3, 5 et 12. Le résidu à l'axe -X coordonne l'ion Ca2+ par l'intermédiaire d'une molécule d'eau pontée. La boucle du motif de la main EF a un ligand bidenté (acide glutamique ou acide aspartique) sur l'axe -Z.
Les pseudo mains EF se trouvent exclusivement dans la partie N-terminale des protéines S100 et des protéines similaires. La pseudo boucle chélatant Ca2+ est formée de 14 acides aminés principalement par les groupes carbonyles de la chaine polypeptidique d'acides aminés en position 1, 4, 6, 9.
Il existe plusieurs types de protéines bactériennes et virales impliquées dans la signalisation et l'homéostasie du calcium qui disposent de motifs proches de la main EF. Les variations structurales observées sur le motif concernent principalement la longueur de la boucle, reliant les deux hélices alpha, chélatant le Ca2+ tout en conservant des propriétés de coordination comparable au motif main EF classique. Par exemple le site de fixation du Ca2+ de la protéine de transport du D-glucose est formé d'une boucle à neuf acides aminés ; le Ca2+ est coordonné à sept atomes d'oxygène d'acides aminés, cinq d'entre eux sont situés sur la boucle similaire à la boucle présente dans le motif EF, les deux autres proviennent d'un groupe carboxylate d'un acide glutamique éloigné. Un autre exemple est un nouveau domaine appelé Excalibur (domaine de fixation extracellulaire du Ca2+ ou extracellular Ca2+-binding region) isolé sur Bacillus subtilis. Il est formé d'une boucle de dix acides aminés très proches de ceux observés sur la boucle de la main EF classique.
Il existe une grande diversité des régions flanquantes du site de chélation de Ca2+ chez les bactéries, un motif hélice-boucle-brin est observé au lieu d'hélice-boucle-hélice sur le récepteur périplasmique du galactose/glucose chez Salmonella typhimurium (fichier PBD : 1gcg)[2] ou sur le transporteur d'alginate chez Sphingomonas sp ; sur d'autres cas la première hélice est manquante comme pour un protecteur d'antigène chez (Bacillus anthracis, fichier PDB : 1acc)[3] ou de dockerin chez Clostridium thermocellum (fichier PDB : 1daq)[4].
Les mains EF sont généralement organisées par paires. Ces paires sont formées de deux mains EF classiques ou d'une main EF classique et d'une pseudo main EF. Dans le cas de protéines formées de nombre impaire de mains EF comme dans le cas de la penta-calpaïne, une organisation en dimère ou pseudo-dimère des mains EF est observée. La présence de site unique de main EF dans une protéine est considérée comme caractéristique de zone d'interaction avec d'autres protéines comme le motif main EF présent dans les protéines NKD1 et NKD2 leur permettant de se lier aux protéines DVL1, DVL2 et DVL3.
Fonction biologique
[modifier | modifier le code]Il existe deux fonctions biologiques pour les motifs main EF, une fonction de signalisation et une fonction de transport, de stockage. Les protéines de signalisation sont les plus nombreuses et les plus connues comme la calmoduline, la troponine C, S100B. La présence ou l'absence de Ca2+ provoque des changements structuraux significatifs, en revanche les protéines de transport ou de stockage comme la calbindine D9k ne subissent pas de changements conformationnels si le site de fixation du Ca2+ est occupé ou libre.
Notes et références
[modifier | modifier le code]- (en) Y Zhou, W Yang, M Kirberger, HW Lee, G Ayalasomayajula et JJ Yang, « Prediction of EF-hand calcium-binding proteins and analysis of bacterial EF-hand proteins », Proteins, vol. 65, no 3, , p. 643–655 (PMID 16981205, DOI 10.1002/prot.21139)
- (en) MM Flocco et SL Mowbray, « The 1.9 A x-ray structure of a closed unliganded form of the periplasmic glucose/galactose receptor from Salmonella typhimurium. », Journal of Biological Chemistry, vol. 269, no 12, , p. 8931-8936 (PMID 8132630, DOI 10.2210/pdb1gcg/pdb)
- (en) C Petosa, RJ Collier, KR Klimpel, SH Leppla et RC Liddington, « Crystal structure of the anthrax toxin protective antigen. », Nature, vol. 385, , p. 833-838 (PMID 9039918, DOI 10.1038/385833a0)
- (en) BL Lytle, BF Volkman, WM Westler, MP Heckman et JH Wu, « Solution structure of a type I dockerin domain, a novel prokaryotic, extracellular calcium-binding domain », Journal of Molecular Biology, vol. 307, , p. 745-753 (PMID 11273698, DOI 10.1006/jmbi.2001.4522)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « EF hand » (voir la liste des auteurs).
